A. ATOM

Yang dengan gaya itu pula dapat berikatan dengan atom lainnya dan membentuk sebuah molekul. Yang hingga kini, atom tidak dapat dilihat dengan menggunakan alat optik manapun termasuk mikroskop. Atom yang mengandung jumlah proton dan elektron yang sama bersifat netral.
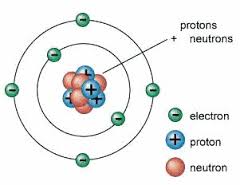
Sedangkan jika jumlah proton lebih banyak, maka atomnya bermuatan positif, jika jumlah elektron lebih banyak, maka atomnya bermuatan prositif. Dan jika jumlah elektron lebih banyak, maka atomnya bermuatan negatif. Lebih dari 99,9% massa atom berpusat pada inti atom, atom terdiri dari 3 partikel dasar yaitu:
- Proton ialah Partikel bermuatan positif (+1), yang diameternya hanya 1/3 diameter elektron, tetapi memiliki massa sekitar 1840 kali massa elektron.
- Elektron ialah partikel bermuatan negatif (-1), memiliki massa paling ringan yaitu hanya 1/1840 kali massa proton atau neutron.
- Neutron ialah partikel tidak bermuatan “netral” memiliki massa yang kira-kira sama dengan gabungan massa proton dan elektron.
1. Teori Atom John Dalton
1. Atom merupakan bagian terkecil dari materi yang sudah tidak dapat dibagi lagi
2. Atom digambarkan sebagai bola pejal yang sangat kecil, suatu unsur memiliki atom-atom yang identik dan berbeda untuk unsur yang berbeda
3. Atom-atom bergabung membentuk senyawa dengan perbandingan bilangan bulat dan sederhana. Misalnya air terdiri atom-atom hidrogen dan atom-atom oksigen
4. Reaksi kimia merupakan pemisahan atau penggabungan atau penyusunan kembali dari atom-atom, sehingga atom tidak dapat diciptakan atau dimusnahkan.
2. Atom digambarkan sebagai bola pejal yang sangat kecil, suatu unsur memiliki atom-atom yang identik dan berbeda untuk unsur yang berbeda
3. Atom-atom bergabung membentuk senyawa dengan perbandingan bilangan bulat dan sederhana. Misalnya air terdiri atom-atom hidrogen dan atom-atom oksigen
4. Reaksi kimia merupakan pemisahan atau penggabungan atau penyusunan kembali dari atom-atom, sehingga atom tidak dapat diciptakan atau dimusnahkan.
Kelebihan model atom John Dalton:
Mulai membangkitkan minat terhadap penelitian mengenai model atom dan menjelaskan apa yang tidak dijelaskan pada teiri atom Domocritus.
a. Setiap unsur terdiri dari partikel yang sangat keci yang dinamakan dengan atom
b. Atom dari unsur yang sama memiliiki sifat yang sama begitu pula bila atom dari unsur berbeda maka akan memiliki sifat yang beda pula
c. Atom dari suatu unsur tidak dapat diubah menjadi atom unsur lain dengan reaksi kimia, dan juga atom tidak dapat dimusnahkan.
d. Atom-atom dapat bergabung membentuk gabungan atom yang disebut molekul
e. Dalam senyawa, perbandingan massa masing-masing unsur adalah tetap
Kelemahan model atom John Dalton :
Teori atom Dalton tidak dapat menerangkan suatu larutan dapat menghantarkan arus listrik. Bagaimana mungkin bola pejal dapat menghantarkan arus listrik? padahal listrik adalah elektron yang bergerak.
Mulai membangkitkan minat terhadap penelitian mengenai model atom dan menjelaskan apa yang tidak dijelaskan pada teiri atom Domocritus.
a. Setiap unsur terdiri dari partikel yang sangat keci yang dinamakan dengan atom
b. Atom dari unsur yang sama memiliiki sifat yang sama begitu pula bila atom dari unsur berbeda maka akan memiliki sifat yang beda pula
c. Atom dari suatu unsur tidak dapat diubah menjadi atom unsur lain dengan reaksi kimia, dan juga atom tidak dapat dimusnahkan.
d. Atom-atom dapat bergabung membentuk gabungan atom yang disebut molekul
e. Dalam senyawa, perbandingan massa masing-masing unsur adalah tetap
Kelemahan model atom John Dalton :
Teori atom Dalton tidak dapat menerangkan suatu larutan dapat menghantarkan arus listrik. Bagaimana mungkin bola pejal dapat menghantarkan arus listrik? padahal listrik adalah elektron yang bergerak.
2. Teori Atom J. J. Thomson
Berdasarkan penemuan tabung katode yang lebih baik oleh William Crookers, maka J.J. Thomson meneliti lebih lanjut tentang sinar katode dan dapat dipastikan bahwa sinar katode merupakan partikel, sebab dapat memutar baling-baling yang diletakkan diantara katode dan anode. Dari hasil percobaan ini, Thomson menyatakan bahwa sinar katode merupakan partikel penyusun atom (partikel subatom) yang bermuatan negatif dan selanjutnya disebut elektron.
Atom merupakan partikel yang bersifat netral, oleh karena elektron bermuatan negatif, maka harus ada partikel lain yang bermuatan positifuntuk menetrallkan muatan negatif elektron tersebut.
Kelebihan model atom J.J Thomson : Membuktikan adanya partikel lain yang bermuatan negatif dalam atom. Berarti atom bukan merupakan bagian terkecil dari suatu unsur.
Kelemahan model atom J.J Thomson :
Model Thomson ini tidak dapat menjelaskan susunan muatan positif dan negatif dalam bola atom tersebut.
3. Teori Atom Rutherford
Rutherford bersama dua orang muridnya (Hans Geigerdan Erners Masreden) melakukan percobaan yang dikenal dengan hamburan sinar alfa (λ) terhadap lempeng tipis emas. Sebelumya telah ditemukan adanya partikel alfa, yaitu partikel yang bermuatan positif dan bergerak lurus, berdaya tembus besar sehingga dapat menembus lembaran tipis kertas. Percobaan tersebut sebenarnya bertujuan untuk menguji pendapat Thomson, yakni apakah atom itu betul-betul merupakan bola pejal yang positif yang bila dikenai partikel alfa akan dipantulkan atau dibelokkan. Dari pengamatan mereka, didapatkan fakta bahwa apabila partikel alfa ditembakkan pada lempeng emas yang sangat tipis, maka sebagian besar partikel alfa diteruskan (ada penyimpangan sudut kurang dari 1°), tetapi dari pengamatan Marsden diperoleh fakta bahwa satu diantara 20.000 partikel alfa akan membelok sudut 90° bahkan lebih.
Berdasarkan gejala-gejala yang terjadi, diperoleh beberapa kesipulan beberapa berikut:
1. Atom bukan merupakan bola pejal, karena hampir semua partikel alfa diteruskan
2. Jika lempeng emas tersebut dianggap sebagai satu lapisanatom-atom emas, maka didalam atom emas terdapat partikel yang sangat kecil yang bermuatan positif.
3. Partikel tersebut merupakan partikelyang menyusun suatu inti atom, berdasarkan fakta bahwa 1 dari 20.000 partikel alfa akan dibelokkan. Bila perbandingan 1:20.000 merupakan perbandingan diameter, maka didapatkan ukuran inti atom kira-kira 10.000 lebih kecil daripada ukuran atom keseluruhan.
Berdasarkan fakta-fakta yang didapatkan dari percobaan tersebut, Rutherford mengusulkan model atom yang dikenal dengan Model Atom Rutherford yang menyatakan bahwa Atom terdiri dari inti atom yang sangat kecil dan bermuatan positif, dikelilingi oleh elektron yang bermuatan negatif. Rutherford menduga bahwa didalam inti atom terdapat partikel netral yang berfungsi mengikat partikel-partikel positif agar tidak saling tolak menolak.penemuannya tersebut, Thomson memperbaiki kelemahan dari teori atom dalton dan mengemukakan teori atomnya yang dikenal sebagai Teori Atom Thomson. Yang menyatakan bahwa:
“Atom merupakan bola pejal yang bermuatan positif dan didalamya tersebar muatan negatif elektron”
Kelebihan Model Atom Rutherford :
Bahwa atom memiliki inti atom yang bermuatan positif dan disekelilingnya terdapat elektron yang mengelilinya.
Kelemahan Model Atom Rutherford :
Menurut hukum fisika klasik, elektron yang bergerak mengelilingi inti memancarkan energi dalam bentuk gelombang elektromagnetik. Akibatnya, lama-kelamaan elektron itu akan kehabisan energi dan akhirnya menempel pada inti.
a. Model atom rutherford ini belum mampu menjelaskan dimana letak elektron dan cara rotasinya terhadap ini atom.
b. Elektron memancarkan energi ketika bergerak, sehingga energi atom menjadi tidak stabil.
c. Tidak dapat menjelaskan spektrum garis pada atom hidrogen (H).
4. Teori Atom Bohr
ada tahun 1913, pakar fisika Denmark bernama Neils Bohr memperbaiki kegagalan atom Rutherford melalui percobaannya tentang spektrum atom hidrogen. Percobaannya ini berhasil memberikan gambaran keadaan elektron dalam menempati daerah disekitar inti atom. Penjelasan Bohr tentang atom hidrogen melibatkan gabungan antara teori klasik dari Rutherford dan teori kuantum dari Planck, diungkapkan dengan empat postulat, sebagai berikut:
1. Hanya ada seperangkat orbit tertentu yang diperbolehkan bagi satu elektron dalam atom hidrogen. Orbit ini dikenal sebagai keadaan gerak stasioner (menetap) elektron dan merupakan lintasan melingkar disekeliling inti.
2. Selama elektron berada dalam lintasan stasioner, energi elektron tetap sehingga tidak ada energi dalam bentuk radiasi yang dipancarkan maupun diserap.
3. Elektron hanya dapat berpindah dari satu lintasan stasioner ke lintasan stasioner lain. Pada peralihan ini, sejumlah energi tertentu terlibat, besarnya sesuai dengan persamaan planck, ΔE = hv.
4. Lintasan stasioner yang dibolehkan memilki besaran dengan sifat-sifat tertentu, terutama sifat yang disebut momentum sudut. Besarnya momentum sudut merupakan kelipatan dari h/2∏ atau nh/2∏, dengan n adalah bilangan bulat dan h tetapan planck.
Menurut model atom bohr, elektron-elektron mengelilingi inti pada lintasan-lintasan tertentu yang disebut kulit elektron atau tingkat energi. Tingkat energi paling rendah adalah kulit elektron yang terletak paling dalam, semakin keluar semakin besar nomor kulitnya dan semakin tinggi tingkat energinya.
Kelemahan Model Atom Neils Bohr :
a. Elektron-elektron yang mengelilingi inti mempunyai lintasan dan energi tertentu.
b. Dalam orbital tertentu, energi elektron adalah tetap. Elektron akan menyerap energi jika berpindah ke orbit yang lebih luar dan akan membebaskan energi jika berpindah ke orbit yang lebih dalam
a. Elektron-elektron yang mengelilingi inti mempunyai lintasan dan energi tertentu.
b. Dalam orbital tertentu, energi elektron adalah tetap. Elektron akan menyerap energi jika berpindah ke orbit yang lebih luar dan akan membebaskan energi jika berpindah ke orbit yang lebih dalam
Kelebihan model atom Bohr :
Atom terdiri dari beberapa kulit/subkulit untuk tempat berpindahnya electron dan atom membentuk suatu orbit dimana inti atom merupakan positif dan disekelilingnya terdapat elektron.
Kelemahan model atom Bohr
a. Tidak dapat menjelaskan efek Zeeman dan efek Strack.
b. Tidak dapat menerangkan kejadian-kejadian dalam ikatan kimia dengan baik, pengaruh medan magnet terhadap atom-atom, dan spektrum atom yang berelektron lebih banyak.
Atom terdiri dari beberapa kulit/subkulit untuk tempat berpindahnya electron dan atom membentuk suatu orbit dimana inti atom merupakan positif dan disekelilingnya terdapat elektron.
Kelemahan model atom Bohr
a. Tidak dapat menjelaskan efek Zeeman dan efek Strack.
b. Tidak dapat menerangkan kejadian-kejadian dalam ikatan kimia dengan baik, pengaruh medan magnet terhadap atom-atom, dan spektrum atom yang berelektron lebih banyak.
5. Teori Atom Modern
Model atom mekanika kuantum dikembangkan oleh Erwin Schrodinger (1926).Sebelum Erwin Schrodinger, seorang ahli dari Jerman Werner Heisenberg mengembangkan teori mekanika kuantum yang dikenal dengan prinsip ketidakpastian yaitu “Tidak mungkin dapat ditentukan kedudukan dan momentum suatu benda secara seksama pada saat bersamaan, yang dapat ditentukan adalah kebolehjadian menemukan elektron pada jarak tertentu dari inti atom”.
Daerah ruang di sekitar inti dengan kebolehjadian untuk mendapatkan elektron disebut orbital. Bentuk dan tingkat energi orbital dirumuskan oleh Erwin Schrodinger.Erwin Schrodinger memecahkan suatu persamaan untuk mendapatkan fungsi gelombang untuk menggambarkan batas kemungkinan ditemukannya elektron dalam tiga dimensi.
B.Molekul
Molekul adalah kumpulan dua atom atau bahkan lebih yang ada di dalam suatu susunan tertentu yang terikat oleh gaya kimia atau ikatan kimia. Molekul terbentuk dari adanya dua atom atau bahkan lebih yang saling berkaitan antara yang satu dengan yang lainnya dan juga memiliki unsur- unsur yang sama, misal O2 yang ada pada sebuah oksigen atau pada atom yang mempunyai unsur yang berbeda yang sering disebut dengan sebutan molekul senyawa. Contoh H2O yang terdiri dari dua atom H dan juga satu atom yaitu O.
atom- atom itu harus berhubungan dengan kuat, sebab atom yang tidak kovalen tidak akan bisa dianggap sebagai molekul tunggal. Molekul juga sering disebut sebagai salah satu dari bagian atom yang paling kecil dan tidak bisa dipecahkan dari senyawa kimia yang terdiri dari dua atom atau bahkan lebih yang berkaitan antara yang satu dengan yang lainnya.
🐬 Molekul Unsur
Catatan :
- Molekul unsur yang terdiri atas 2 atom disebut molekul diatomik
- Molekul unsur yang terdiri atas 4 atom disebut molekul tetraatomik
- Molekul unsur yang terdiri atas 8 atom disebut molekul oktaatomik
🐬 Molekul Senyawa
Molekul yang tersusun atas lebih dari satu jenis atom dinamakan molekul senyawa.
C. ION
Ion adalah atom atau sekumpulan atom yang bermuatan listrik. Ion bermuatan negatif, yang menangkap satu atau lebih elektron, disebut anion, karena dia tertarik menuju anode. Ion bermuatan positif, yang kehilangan satu atau lebih elektron, disebut kation, karena tertarik ke katode. Proses pembentukan ion disebut ionisasi. Atom atau kelompok atom yang terionisasi ditandai dengan tikatas n+ atau n-, di mana n adalah jumlah elektron yang hilang atau diperoleh.
📦 Anion
Anion adalah ion negatif yang terbentuk ketika atom nonlogam memperoleh satu atau lebih elektron. Anion dinamakan demikian karena mereka tertarik ke anoda (bidang positif) dalam medan listrik. Atom biasanya mendapatkan elektron sehingga mereka akan memiliki konfigurasi elektron seperti gas mulia. Semua unsur dalam kelompok 17 memiliki tujuh elektron valensi karena konfigurasi ns2np5 dibagian terluarnya. Oleh karena itu, setiap unsur akan mendapatkan satu elektron dan menjadi anion dengan muatan -1. Demikian juga, Kelompok 16 unsur membentuk ion dengan muatan -2, dan Kelompok 15 non logam membentuk ion dengan muatan -3.
Penamaan anion sedikit berbeda dari penamaan kation. Akhir dari nama unsur tersebut dihilangkan dan diganti dengan akhiran-ida. Misalnya, F– adalah ion fluorida, sedangkan O2–adalah ion oksida. Seperti halnya dengan kation, muatan anion ditandai dengan superscript mengikuti simbol. Anion yang umum tercantum dalam Tabel di bawah ini:
Tabel Anion
No
|
Rumus
|
Nama Ion
|
No
|
Rumus
|
Nama Ion
|
1
|
OH-
|
Hidroksida
|
16
|
SO42-
|
Sulfat
|
2
|
O2-
|
Oksida
|
17
|
PO33-
|
Fosfit
|
3
|
F-
|
Fluorida
|
18
|
PO43-
|
Fosfat
|
4
|
Cl-
|
Klorida
|
19
|
AsO33-
|
Arsenit
|
5
|
Br-
|
Bromida
|
20
|
AsO43-
|
Arsenat
|
6
|
I-
|
Iodida
|
21
|
SbO33-
|
Antimonit
|
7
|
CN-
|
Sianida
|
22
|
SbO43-
|
Antimonat
|
8
|
S-2
|
Sulfida
|
23
|
ClO-
|
Hipoklorit
|
9
|
CO32-
|
Karbonat
|
24
|
ClO2-
|
Klorit
|
10
|
SiO32-
|
Silikat
|
25
|
ClO3-
|
Klorat
|
11
|
C2O42-
|
Oksalat
|
26
|
ClO4-
|
Perklorat
|
12
|
CH3COO-
|
Asetat
|
27
|
MnO4-
|
Permanganat
|
13
|
NO2-
|
Nitrit
|
28
|
MnO42-
|
Manganat
|
14
|
NO3-
|
Nitrat
|
29
|
CrO42-
|
Kromat
|
15
|
SO32-
|
Sulfit
|
30
|
Cr2O72-
|
Dikromat
|
📦 Kation
Kation adalah ion bermuatan positif yang terbentuk ketika sebuah atom kehilangan satu atau lebih elektron selama reaksi kimia.Proton membawa muatan listrik positif, neutron tidak membawa muatan, dan elektron bermuatan negatif. Inti atom terdiri dari proton dan neutron bergabung bersama-sama, yang membuat hampir semua berat atom. Elektron melingkar di sekitar inti dalam orbital, atau tingkat energi. Partikel-partikel ini penting karena cara mereka diatur di sekitar inti menentukan sifat-sifat atom – apakah itu rentan untuk mendapatkan atau kehilangan elektron.
Atom ingin memiliki tingkat energi mereka terisi penuh dengan elektron, dan mereka akan menyerahkan atau mengambil elektron dari atom lain untuk melakukannya. Inilah yang terjadi selama reaksi kimia. Ketika atom kehilangan atau penambahan elektron selama reaksi, itu menjadi ion.
Sebuah kation terbentuk ketika sebuah atom kehilangan elektron selama reaksi kimia. Ini memiliki muatan listrik positif, karena memiliki lebih banyak proton daripada elektron, dan akan tertarik kepada anion, yang memiliki muatan negatif.
Tabel Kation
No
|
Rumus
|
Nama Ion
|
No
|
Rumus
|
Nama Ion
|
1
|
Na+
|
Natrium
|
13
|
Pb2+
|
Timbel (II)
|
2
|
K+
|
Kalium
|
14
|
Pb4+
|
Timbel (IV)
|
3
|
Mg2+
|
Magnesium
|
15
|
Fe2+
|
Besi (II)
|
4
|
Ca2+
|
Kalsium
|
16
|
Fe3+
|
Besi (III)
|
5
|
Sr2+
|
Stronsium
|
17
|
Hg+
|
Raksa (I)
|
6
|
Ba2+
|
Barium
|
18
|
Hg2+
|
Raksa (II)
|
7
|
Al3+
|
Aluminium
|
19
|
Cu+
|
Tembaga (I)
|
8
|
Zn2+
|
Zink
|
20
|
Cu2+
|
Tembaga (II)
|
9
|
Ni2+
|
Nikel
|
21
|
Au+
|
Emas (I)
|
10
|
Ag+
|
Perak
|
22
|
Au3+
|
Emas (II)
|
11
|
Sn2+
|
Timah (II)
|
23
|
Pt4+
|
Platina (IV)
|
12
|
Sn4+
|
Timah (IV)
|
24
|
NH4+
|
Amonium
|


















8. https://imgur.com/a/WvEsSo9 https://imgur.com/a/nYHLaHv https://imgur.com/a/yfXLS5x https://imgur.com/a/NIktiGA https://imgur.com/a/A3nz00t https://imgur.com/a/XMzmCYe https://imgur.com/a/klsynBF
BalasHapus